3.5mm一次性内窥镜获批,儿科医生创立EvoEndo闯入百亿新蓝海

内窥镜是临床上一类常用且昂贵的设备,传统内窥镜至少配有一台主机和两条软镜,总进院价约200万元。同时旺盛的需求也催生了内窥镜10亿级的市场,2019年到2021年全球内窥镜行业融资总额从0.93亿美元增至8.69亿美元,两年翻了近10倍。
几十上百万一台的传统内窥镜肯定不能一次性使用,并且产品在设计时就定位为可反复使用的产品,每次使用之后充分洗消即可。但内窥镜十分精密且结构复杂,难以充分洗消,在美国急救医学研究所每年发布的《十大医疗技术危害》中,内窥镜导致的交叉感染问题常年在列。
内窥镜大致可分为主机和镜体,目前制约成本的主要是镜体上的图像传感器,随着成本更低的CMOS传感器逐渐替代CCD,一次性内窥镜逐渐进入市场。
儿科胃病医生创立EvoEndo,解决儿童内窥镜难题
EvoEndo是美国一家开发一次性非镇静内窥镜的医疗器械公司,成立于2017年,总部位于美国科罗拉多州。目前担任首席执行官的是毕业于斯坦福大学的Heather Underwood,一名从事医疗设备行业多年的企业家。近日,该公司开发的EvoEndo® 一次性内窥镜系统获得FDA的510(k) 许可。
EvoEndo由科罗拉多儿童医院的呼吸消化科团队共同创立,包括儿童肠胃病专家Joel Friedlander博士、肺病专家Robin Deterding等。一群儿科医生聚在一起开发内窥镜,主要目的当然是解决儿童的临床需求。
近几年,儿童上消化道疾病患者不断增加,内镜检查是儿童消化系统疾病重要的诊治方法,可用于观察从咽部、食管、胃到十二指肠近段的整个上消化道。并且由于内镜检查是探入式的,直观清楚且便于病理化验取材,所以即使ct等影像手段比内窥镜更舒适,内窥镜检查依然是消化系统检查的首选。
目前临床较为常用的是普通电子内镜,其探头及镜身外径一般为9~11mm。这种普通内镜在临床中经口腔进镜,碰到舌根会引起咽反射,患者处在紧张、痛苦等应激状态下还容易发生心脑血管意外。
近几年无痛内镜和超细经鼻内镜已经逐步普及。无痛内镜和普通内镜最大的区别是无痛内镜采用静脉麻醉,有效提升患者的依从性和舒适度。
但是无痛内镜也有弊端,首先全身麻醉药品价格相对昂贵,其次麻醉前准备和苏醒都要时间,最重要的是麻醉要额外建立静脉通道,给患者加重负担,降低了心脑血管风险却加重了麻醉风险。
无痛内镜检查总体并发症发生率不高,不到5‰,但大部分都和麻醉药物相关。
对儿童来说,超细经鼻内镜是一个很好的选择。常见的经鼻内镜外径4mm~6mm,从鼻腔入镜,避开了舌根直接进入消化道,减少了不适症状,所以也不必使用静脉麻醉。
EvoEndo®一次性内窥镜系统镜身外径3.5mm
EvoEndo通过FDA批准的EvoEndo®一次性内窥镜系统就是一种超细经鼻内窥镜,主要分为4个部分,前端传感器、插入软管、操作手柄、图像处理主机。
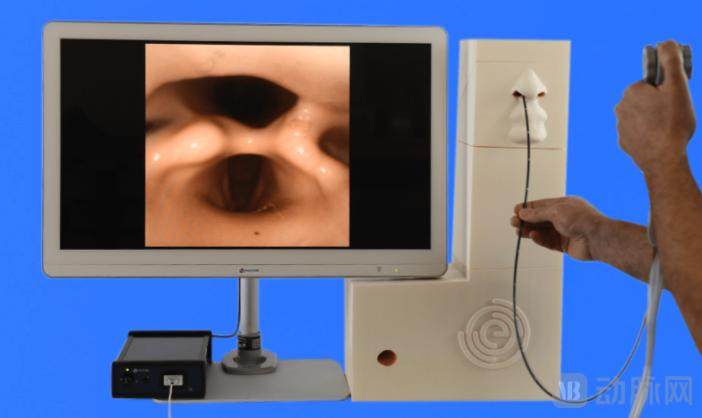
EvoEndo®一次性内窥镜系统产品图 图源EvoEndo官网
首先是前端传感器部分。经鼻内窥镜如果直径过大可能会刺激甚至损伤鼻粘膜,EvoEndo内窥镜的探头及镜身外径为3.5mm,EvoEndo认为这个外径足够小,几乎可以通过所有的鼻子,在使用内窥镜检查时不需要静脉麻醉也能获得舒适体验。
一部分医生患者对普通一次性内窥的性能抱有迟疑态度,认为“如果没有特殊需求,还是用传统内窥镜更好”,更何况EvoEndo一次性内窥镜采用的是技术难度更高的直径为3.5mm的经鼻内窥镜。EvoEndo在官网中介绍其镜头与传统可重复使用的内窥镜镜头质量相当,但在其官网中并没有找到具体数据。
从前端传感器到手柄这一部分是插入软管,EvoEndo内窥镜的插入软管长1.1m,这个长度足以进行完整的儿科经鼻上消化道的检查。
一个内窥镜插入软管通常要包含送水送气的水气通道(使视野清晰便于观察)、抽吸(活检)通道、传导照明的传光束、传导图像的传像束,和角度控制线。如何把这复杂的结构放在3.5mm的直径中是一个问题,EvoEndo内窥镜决定把水气通道和抽吸通道集成在一起,并在手柄上设置有不同的激活按钮可以操纵进水、进气。
EvoEndo内窥镜手柄上留有一个2mm活检钳通道。通常内窥镜的外径越小,配备的活检通道也越小,就需要专门且昂贵的活检钳,但EvoEndo的2mm活检钳通道可以容纳标准直径且价格合理的儿科活检钳,不必配置专门且昂贵的活检钳。
EvoEndo内窥镜可以向四个方向偏转,医生能以120° 的视野进行检查,手柄中间及左右两端一共三个旋钮支持这项功能。
手柄后端有一根线连接到EvoEndo 控制器,控制器处理来自内窥镜的视频和图像,通过 HDMI 或 USB 直接输出到医疗监视器或计算机系统,可以与业内标准的内窥镜报告软件一起使用。该处理器只有 6×8 英寸,可以随身携带。
配合VR娱乐设备,与南微医学合作分销
以上是EvoEndo内窥镜的硬件创新部分。对儿童来说害怕内窥镜检查更多的是心理障碍,EvoEndo为了使患者放松,为每位患者配备了VR娱乐设备。同时由于患者是清醒的,医生可以和患者交流沟通缓解患者紧张,患者有任何不适都可以随时提出来,医生及时调整。
该内窥镜主要面向儿童,但对部分成人也适用,例如年老体弱或有心肺疾病不耐受传统胃镜的人。
EvoEndo官网中介绍,由于减少了静脉麻醉功能,术前禁食从6~8小时缩短到2~4小时,术后恢复时间从至少一个小时到即刻可以进行日常活动。
这对于需要频繁进行内镜检查的各种上消化道疾病(例如嗜酸性食管炎 (EoE)、吞咽困难、乳糜泻、胃食管反流病等)患者来说,无疑可以提高就医舒适度。
一项2021年发表在《过敏临床免疫实践》杂志上的研究结果称,使用VR设备能够更早检测嗜酸性食管炎,EvoEndo的创始人之一Joel Friedlander也参与本项研究。
EvoEndo内窥镜作为一次性内窥镜即用即扔,虽然看似浪费,但我们来算一下经济总账。
对医院来说,一次性内窥镜无需清洗、消毒,即用即扔没有损耗成本;对社会来说,一人一镜避免交叉感染,减少疾病流行;对患者来说,没有交叉感染风险,减少并发症处理费用。EvoEndo介绍他们的内窥镜可以在发现症状后即刻开始检查,做完检查就能恢复正常活动,不必为此请假耽误工作。
EvoEndo一次性内窥镜上市后由美国Micro-Tech Endoscopy USA公司分销,Micro-Tech Endoscopy USA是南微医学的全资子公司,主营业务是器械销售,本次合作是南微医学一次性内窥镜布局的一部分。为了更好推广EvoEndo内窥镜系统,EvoEndo还提供教育培训组件。
近日,EvoEndo获得了 840 万美元的 A轮融资,本轮融资由创始投资者 TLP Investment Partners LLC (TLP) 领投,Sunshine Charitable Foundation等参与融资。据EvoEndo介绍本轮融资将用于启动EvoEndo 一次性内窥镜系统的初期商业计划,具体是增加团队成员和生产能力,还要用这笔资金进行临床和上市后监测研究。
全球一次性内窥镜均处于初期发展阶段,国内有望弯道超车
据《中国卫生健康统计年鉴(2019)》数据,2018年中国消化系统疾病的出院患者人数达902.14 万,五年复合增速为17.64%,随着消化系统患者增加,对内窥镜需求也不断增加。
2015年至2019年,全球内窥镜领域投融资规模没有大幅度变化,直到2020年进入融资爆发期,融资事件和融资总额都大幅度攀升,2021年全球有32起融资事件,融资总额约8.69亿美元,同比上升46%。
2021年一次性内窥镜领域发生7起融资事件,吸引腾讯投资、礼来亚洲基金、高瓴创投等机构入局;元禾原点、礼来亚洲基金、同创伟业等机构早已布局,并且多次加注同一家公司,陪伴项目长期成长。
海外一次性内窥镜领先企业有波科和Ambu等,全球首个一次性支气管镜由Ambu 在2009年推出,随后市场上逐步出现一次性喉镜、一次性膀胱镜、一次性胃肠镜、一次性结肠镜、一次性十二指肠镜。近几年,专攻传统内窥镜市场的奥林巴斯等企业也先后入局一次性内窥镜市场。
目前,国内至少有12 家企业布局一次性内窥镜。例如瑞派医疗、华芯医疗、新光维医疗、普生医疗、安清医疗、莱恩瑟特、佑康科技等企业。
国内企业和海外企业在一次性内窥镜领域基本都处于发展初期,国产企业甚至有望实现弯道超车。例如,Ambu、波士顿科学等企业目前上市销售的大部分一次性内窥镜产品都是在 2019 年至2021 年获批,同期国内瑞派医疗、普生医疗等企业的一次性内窥镜产品也获得NMPA批准。
目前国内企业研发或获批的产品主要为一次性膀胱镜及输尿管镜,在一次性喉镜、胃肠镜、结肠镜等方面进展较少,这主要是基于必要性、推广难度和性价比等方面的考虑。
本文来自其他网站,不代表健我头条立场和观点,如若转载,请注明出处:https://news.jianwo.com/detail_39537.html如有版权问题,请联系客服配合您删除这篇文章。
-
0

-

参与讨论

动脉网
最近文章
相关文章
- 2022-06-27
获批9年,280万次扫描,影响了美国卒中治疗窗口标准的RapidAI
2022-06-26成立65年,年营收38亿美元,GORE已提供超5000万例ePTFE医疗植入物
2022-06-25
关注我们
















